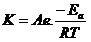اولین بار آب اکسیژنه به وسیله آقای تنارد در سال 1818 تهیه شد. وی با اسیدی کردن پراکسید باریم و خارج کردن آب اضافی از طریق تبخیر در خلاء موفق به تهیه آب اکسیژنه شد.
پراکسید مشتقات پراکسید هیدروژن است که در آن به جای هر هیدروژن یک فلز یک ظرفیتی و یا دو ظرفیتی وجود دارد. پراکسید فلزات قلیایی و قلیایی خاکی به ترتیب دارای فرمول M2O2 و MO2 می باشند. شیمی واکنشهای اکسایشی – کاهشی H2O2 در محلول آبی با پتانسیلهای زیر خلاصه میشود.
H2O2 + 2H+ + 2e → 2H2O E= 1.77V
O2 + 2H+ + 2e → H2O2 E = 0.68V
HO2- + H2O + 2e → 3OH E= - 0.87V
این پتانسیلها نشان میدهند که آب اکسیژنه هم در محیط اسیدی و هم در محیط بازی اکسندهای بسار قوی است و آب اکسیژنه فقط در مقابل اکسندههای بسیار قوی مثل یون منفی-MnO4نقش کاهندگی دارد. محلولهای رقیق یا 30% آب اکسیژنه، به طور وسیعی به عنوان اکسنده مورد استفاده قرار میگیرند. عمل اکسایش به وسیله آب اکسیژنه در محیط اسیدی کند است، در حالی که در محیط بازی معمولا" سریع است. از موارد استفاده آب اکسیژنه می توان به اثر سفید کنندگی در الیاف سلولزی و پارچه ها، ضدعفونی کنندگی و همچنین تولید برخی از مواد شیمیایی اشاره کرد. آب اکسیژنه خالص تقریباً بی رنگ و در برخی موارد آبی کم رنگ به نظر می آید. دمای ذوب و جوش آن به ترتیب 0/43- درجه سلسیوس و 152/1 درجه سلسیوس می باشد. در 20درجه سلسیوس در حالت مایع دارای دانسیته 1.438 است. در آب و الکل و اتر به هر نسبتی حل می شود. درجه اکسیداسیون اکسیژن در آب اکسیژنه برابر 1- است. معمولاً پراکسید هیدروژن به صورت محلول 6% ، 12% و یا 30% آن بیان می گردد که معمولاً به صورت پراکسید هیدروژن 20 حجم، 40 حجم و یا 100 حجم نیز گفته می شود. چگالی وثابت دی الکتریک آب اکسیژنه از آب بیشتر است آب اکسیژنه 40 درصد از آب سنگین تر است. مایع خالص آن در دمای 25درجه سلسیوس ، ε=93 و محلول آبی 60% آن ε=120 می باشد. بنابراین ترکیب جزء حلال های یونی کننده خیلی خوبی هستند ولی به علت قدرت اکسید کنندگی زیاد و نا پایداری، قدرت حل کنندگی آن ها محدود است. محلول مایع آب اکسیژنه به مرور طبق واکنش زیر به آب و اکسیژن تبدیل می شود
2H2O2 (aq) --> 2H2O (l) + O2 (g)
در غیاب کاتالیزور سرعت تجزیه آب اکسیژنه بسیار ملایم است ولی در مقابل فلزاتی چون Pt ، Ag و یا ترکیباتی چون MnO2 وآنزیم ها واکنش شدت می گیرد و به همین دلیل آب اکسیژنه را در ظروف غیر فلزی همراه با یک پایدار کننده مانند اوره نگهداری می کنند.
آب اکسیژنه به صورت یک اکسید کننده و یا احیا کننده در محیط های اسیدی و بازی می تواند به کار رود
: احیا کننده در محیط اسیدی
2KMnO4 + 3H2SO4 + 5H2O2 → K2SO4 + 2MnSO4 + 8H2O + 5O2
اکسید کننده در محیط اسیدی
2 [Fe(CN)6]4- + H2O2 + 2 H+ → 2 [Fe(CN)6]3- + 2 H2O
احیا کننده در محیط بازی
2[Fe(CN)6]3- + H2O2 + 2OH- → 2[Fe(CN)6]4- + 2H2O + O2
اکسید کننده در محیط بازی
Mn2+ + H2O2 → Mn4+ + 2 OH-
سرب (]]) سولفید سیاه رنگ در سرما تحت اثر H2O2 به سولفات سفید رنگ تبدیل می شود.
PbS + 4H2O2 --> PbSO4 + 4H2O
آب اکسیژنه به صورت یک اسید ضعیف عمل کرده زیرا ثابت یونش آن بسیار پایین بوده و مقدار ثابت خودیونش آن 12- 10 × 1.5 است.
این فرمول ساختاری انتراکینول یا 2 اتیل انتراکینول است که براثر اکسایش واز دست دادن 2 اتم هیدروژن به کینون تبدیل می شود
روش تهیه آب اکسیژنه به روش انترا کینول خیلی ارزان است زیرا این واکنش موجب مصرف آنتراکینول نمی شود وفقط اکسیژن وهیدروژن مصرف می کند وکاتا لیزگر واکنش احیاء آن پالادیم است که به روش جذب سطحی شیمیایی انجام می شود.
روش دوم تهیه آب اکسیژنه گرانتر است ولی می توان آب اکسیژنه غلیظ تر تهیه کرد، در روش دوم برقکافت سولفوریک اسید ویا برقکافت محلول آمونیوم سولفات - سولفوریک اسید که منجر به تشکیل پیروکسو دی سولفوریک اسید میشود که براثر هیدرولیز به آب اکسیژنه وسولفوریک اسید تجزیه میگردد وبا تقطیر جزء به جزء غلیظ می کنند.
قدرت پیوند هیدروژنی آب اکسیژنه خیلی قویتر از آب است چون هیدروژن ها مثبت ترند .
تجزیه آب اکسیژنه که آنرا خود اکسایش خود کاهش یا تسهیم نامتناسب میگوییم در محیط بازی سریعتر است و همچنین سرعت تجزیه آن در دمای بالا بیشتر است تجزیه کاتالیزگری بوسیله کاتیونهای فلزی و واکنشهای دیگر تولید رادیکال های آزاد می کند