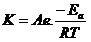رابطه آرنیوس برای چه نوع واکنشهایی قابلیت کاربرد دارد؟
رابطه آرنیوس تاثیر دما ورابطه نمایی آن بر سرعت همه واکنش هایی شیمیایی است ولی برای واکنش های گرماگیر ملموس تر است
مقدار R در این رابطه برای یک گونه ی گازی ثابت عمومی گازها برای یک مول گاز است.
می توان از رابطه آرنیوس برای مایع یا جامد هم استفاده نمود اساس آن را با فرضیاتی برای تمام واکنشها به کار مببربم
ثابت گازها ۸٫۳۱۴ ژول بر مول کلوین و ۰٫۰۸۲ لیتر اتمسفر بر مول کلوین است و در صورتی که برحسب کالری باشد 1.98 می توان در نظر گرفت. اگر این رابطه برای این فازها پاسخ گو نباشد در آنصورت پس نباید بتوان ثابت سرعت را برای مواد جامد یا مایع بدست آورد بحث جامدات که جدا است ولی مایعات فرکانس برخوردشان کمتر است که در معادله آرنیوس تحت عنوان فاکتور احتمال امده است
رابطه بین دما و ثابت سرعت(رابطه آرنیوس)
درA فاکتور احتمال شکل مولکول و عوامل دخیل در برخورد وجاذبه های مولکولی و.... دخالت داده می شود. معادله آرنیوس بر اساس نظریه برخورد و برای فاز گاز است .نتیجه آن برای محلول ها هم همسو با گازها ست نه مشابه.
رابطه ارنیوس برای محاسبه انرزی فعالسازی است ولی ثابت سرعت را هم میتوان از روی انرژی فعالسازی معلوم محاسبه کرد.
ثابت های سرعت را در دو دمای متفاوت محاسبه کرده ولگاریتم2 K به K1 را برحس دما رسم می کنیم.