برای دانلود فیلم اینجا کلیک کنید.
-
موضوعات بحث شده در تلگرام و جمع بندی آن ها
(۱۷۰) -
پاورپوینت های شیمی دوم دبیرستان
(۵) -
پاورپوینت های شیمی سوم دبیرستان
(۶) -
کتب درسی
(۶) -
پاورپوینت شیمی چهارم دبیرستان
(۱) -
سوالات کتب درسی
(۴) -
آزمایش های جذاب شیمی
(۳) -
انیمیشن های فصل به فصل شیمی دوم دبیرستان
(۱۶) -
انیمیشن و فیلم های شیمی سوم دبیرستان
(۴) -
مجموعه تست های شیمی سوم دبیرستان
(۲) -
نمونه سوالات تستی و تشریحی شیمی دوم دبیرستان
(۷) -
نمونه سوالات تستی و تشریحی شیمی سوم دبیرستان
(۷) -
پاسخ فکرکنید ها و خورابیازمایید های کتاب های درسی
(۶) -
سوالات تستی و تشریحی شیمی چهارم دبیرستان
(۹) -
جزوه اموزشی کتب درسی
(۱۱) -
سوالات بررسی شده در انجمن
(۲) -
نمونه سوالات همکاران از کتب شیمی 2و3و4
(۵) -
نمونه سوالات شیمی دهم
(۱۱) -
پاسخ سوالات شیمی دهم و ازمایشگاه علوم
(۷)
- آبان ۱۳۹۷ (۱)
- ارديبهشت ۱۳۹۷ (۲)
- فروردين ۱۳۹۷ (۲)
- بهمن ۱۳۹۶ (۳)
- آذر ۱۳۹۶ (۱)
- آبان ۱۳۹۶ (۳)
- مهر ۱۳۹۶ (۱)
- شهریور ۱۳۹۶ (۱)
- ارديبهشت ۱۳۹۶ (۱)
- بهمن ۱۳۹۵ (۱)
- دی ۱۳۹۵ (۱)
- آذر ۱۳۹۵ (۶)
- آبان ۱۳۹۵ (۱)
- مهر ۱۳۹۵ (۲)
- شهریور ۱۳۹۵ (۳)
- خرداد ۱۳۹۵ (۱)
- ارديبهشت ۱۳۹۵ (۳)
- دی ۱۳۹۴ (۳)
- آذر ۱۳۹۴ (۱)
- آبان ۱۳۹۴ (۸)
- مهر ۱۳۹۴ (۴۱)
- شهریور ۱۳۹۴ (۸۵)
- مرداد ۱۳۹۴ (۱۰۱)
- تیر ۱۳۹۴ (۱۰)
- ۹۷/۰۸/۱۰پاسخ سوالات کتاب شیمی دوازدهم
- ۹۷/۰۲/۲۱پاسخ کل پرسش های کتاب شیمی یازدهم
- ۹۷/۰۱/۱۶نمونه سوالات فصل دوم شیمی دهم
- ۹۷/۰۱/۱۶نمونه سوالات فصل دوم شیمی یازدهم
- ۹۶/۰۹/۰۱پاسخ پرسش های فصل اول شیمی یازدهم
- ۹۵/۰۹/۰۸سوالات تستی فصل اول شیمی دهم
- ۹۴/۰۶/۱۸مقایسه قدرت اسیدی اسیدها
- ۹۴/۰۵/۲۳انرژی شبکه بلور و عوامل موثر بر آن
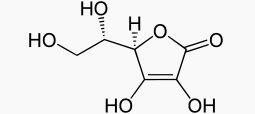
اسکوربیک
اسید یک استر حلقوی است
که خاصیت اسیدی این ماده بیشتر بخاطر هیدروکسیل متصل به پیوند دوگانه در حلقه پنج ضلعی می باشد. زیرا اکسیژن یکی از هیدروکسیل ها می تواند در ساختارهای رزونانسی زیر شرکت نماید.
همان گونه که در شکل مشاهده می شود بار مثبت جزئی روی اکسیژن باعث افزایش قطبیت پیوند و افزایش قدرت اسیدی می شود .البته گروه هیدروکسیل دیگر نیز به علت اثر القایی گروه کربوکسیل دارای خاصیت اسیدی بیش تری نسبت به هیدروکسیل های خارج از حلقه می باشد
البته
این دو هیدروژن در آب قابل تفکیک نمی باشند اما بر اساس تعریف دیوی این دو هیدروژن
اسیدی قابل جانشین شدن بوسیله فلزات فعال می باشد بنابراین آسکوربیک اسید شامل چهار هیدروژن
اسیدی است
نام آیوپاک اوره آمینو متان آمید است. لذا می توان اوره را از خانواده آمید ها دانست یکی از روش های تهیه آمیدها جایگزین شدن گروه آمینی با OH اسید های کربوکسیلیک می باشد در واقع می توان گفت اوره آمیدی است که از جایگزین شدن عامل NH2 به جای OH کربنیک اسید بدست می آید . البته یک روش تهیه آن از تراکم کربن دی اکسید با آمونیاک بدست می آید.
اولین کـسی کـه توانـست واکـنش تولیـد اوره را توضـیح دهـد شخصی بود به نام فرجکویس (Frejaeques) که واکنش تولید اوره را توسط یک واکنش برگشت پذیر توجیـه نمود که در زیر آورده شده است:
+ NH3 NH2CONH2(l) + H2O(l)⇔ (l)+CO2
اوره شدیدا در اب حل می شود ولی وقتی در حضور انزیم اوره آز قرار بگیرد به امونیوم بیکربنات تبدیل می شود که پس از قرار گرفتن در خاکهای کشاورزی یون امونیوم بر اثر8=PH تمایل دارد تا به صورت امونیاک در بیاید و ازاد شود. قدرت بازی اوره نیز به دلیل اثر گروه کربنیل نسبت به آمین ها کاهش چشم گیری دارد pkb=13.9
واکنش ترکیب اکسیژن و نیتروژن با توجه به پیوند محکم سه گانه نیتروژن یک واکنش گرماگیر است که در دماهای بالاتر از 2000 درجه انجام می شود. درحالی که واکنش سوختن همراه با تولید نور و گرماست. لذا این واکنش نمی تواند سوختن باشد. و فقط می توان آن را یک واکنش اکسایش دانست. آنتالپی تشکیل نیتروژن اکسید برابر با 29/91 کیلوژول بر مول است. گاز نیتروژن با اکسیژن در دماهای بسیار بالا ویا در اثر قوس الکتریکی واکنش می دهد پس این واکنش سوختن نمی تواند باشد .
عوامل موثر در قدرت اسیدی:
دو عامل در قدرت اسیدی افزایش قطبیت پیوند هیدروژن اسیدی و پایداری باز مزدوج است. درمورد کربوکسیلیک اسیدها نیز به همین دو عامل می توان اشاره کرد. اما مواردی که ذکر آن مفید است:
1- گروههای آلکیل گروههای الکترون دهنده هستند و قطبیت پیوند O-H را کاهش داده و قدرت اسیدی را کم می کنند. و هرچه تعداد کربن ها بیشتر باشد این الکترون دهی افزایش یافته و قدرت اسیدی بیش تر کاهش می یابد.
2- هالوژنها گروههای الکترون کشنده هستند و قطبیت O-H را افزایش داده و قدرت اسیدی را افزایش می دهند هرچه الکترونگاتیوی بیش تر قطبیت بیش تر و قدرت اسیدی بیش تر است
3- هرچه هالوژن به گروه کربوکسیل نزدیک تر باشد اثر القایی بیش تری داشته قدرت اسیدی را بیش تر افزایش می دهد.
اما این که کدام یک از این عوامل اهمیت بیش تری دارد نمی توان یک قانون کلی ارائه داد و بهترین کار مراجعه به رفرنس ها و استفاده از ثابت یونش است. تا کنون چنین تست هایی مشاهده نشده و بهتر است در کلاس نیز بدون دادن ثابت یونش مطرح نشود.
برای فرمیک اسید PKa برابر با 3.77 و برای 3- کلروپروپانوییک اسید برابر با 4.1میباشد
در این مسئله از آنجا که از آنتالپی و آنتروپی استاندارد استفاده شده باید دما 25 درجه باشد. البته آب در دمای 25 درجه هم می تواند در طبیعت به صورت گاز وجود داشته باشد.
بحث انجام پذیر بودن یا نبودن این واکنش در دمای 25 درجه بحث جداگانه ای است که می دانیم برای انجام پذیر بودن یک واکنش باید واکنش هم از نظر ترمودینامیک و هم از نظر سینیتیک مساعد باشد که در این حالت از نظر سینیتیکی مساعد نیست.
قانون سرعت، سرعت را به صورت تابعی از غلظت واکنش دهنده ها، غلظت محصولات و دما ارائه می دهد.هر فرضیه ای را که در سطح مولکولی در ارتباط با چگونگی انجام واکنش طرح می کنیم باید با قانون سرعت مطابقت داشته باشد، زیرا قانون سرعت مبنای تجربی دارد.
در این مبحث عموما واکنش هایی را در نظر می گیریم که محصولات در قانون سرعت ظاهر نشوند. سرعت واکنش در جنین مواردی به غلظت واکنش دهنده ها و دما بستگی دارد. ابتدا اثر غلظت را بر سرعت واکنش هایی بررسی می کنیم که در دمای ثابتی انجام می شوند. برای واکنش عمومی
aA+bB→cC+dD
قانون سرعت به شکل زیر است.R=k[A]m.[B]n
در این معادله K ثابت سرعت است و m و n مرتبه واکنش دهنده های A و B است .
نکته ی مهمی که باید به خاطر بسپارید این است که اجزای قانون سرعت، مرتبه های سرعت و ثابت سرعت باید به طور تجربی تعیین شوند. آن ها را نمی توان از استوکیومتری واکنش استنتاج کرد. شیمیدانان این اجزا را به طور تجربی چنین تعیین می کنند
1. با استفاده از اندازی گیری غلظت سرعت اولیه را پیدا می کنند
2. با استفاده از سرعت اولیه در چند آزمایش مرتبه های واکنش دهنده ها را به دست می آورند
3. با استفاده از این مقادیر ثابت سرعت را محاسبه می کنند
روش های تجربی متعددی برای انجام مرحله اول، اندازه گیری غلظت ها برای یافتن سرعت های اولیه وجود دارد. در اینجا سه روش عمومی ارائه می شود.
1. در واکنش هایی که مواد رنگی دخالت دارند می توان از روش های طیف سنجی استفاده کرد. به عنوان مثال در اکسایش نیتروژن مونوکسید، فقط محصول نیتروژن دی اکسید رنگی است. با گذشت زمان رنگ قهوه ای مخلوط واکنش پررنگ تر می شود.
2. در واکنش هایی که تعداد مول های گاز تغییر می کند می توان تغییر فشار را دنبال کرد.
3. روش سوم بررسی تغییر هدایت است. در واکنش بین یک هالید آلی و آب HBr تولید شده یک اسید قوی است و به طور کامل به یون های خود تفکیک می شود بنابراین هدایت محلول با زمان افزایش می یابد.
شیمیدانان به کمک روش سرعت های اولیه مرتبه های واکنش را محاسبه و ثابت سرعت واکنش را محاسبه و سپس با استفاده از معادله قانون سرعت می توانند برای هر غلظت اولیه ای از واکنش دهنده ها سرعت را پیش بینی کنند.(شیمی عمومی سیلبربرگ )
نکته مهم اینست که این روش فقط با داشتن غلظت اولیه معلوم و دقیق هر ماده واکنش دهنده قابل تایید بوده در حالیکه سرعت لحظه ای نمی تواند ملاکی برای تعیین مرتبه ها باشد زیرا در لحظاتی پس از شروع واکنش دیگر غلظت ها معلوم ومعین نیست و سریع ترین روشها برای اندازه گیری غلظت لحظه ای در ازمایشگاه زمان قابل ملاحظه ای را صرف میکند که در این م واکنش مقدار دیگری از واکنش دهنده ها را مصرف کرده است .یکی از روشهای سنتیکی برای کاهش خطای این اندازه گیری غلظت در واکنش در حین انجام تکنیک Stoped flow است که مواد واکنش دهنده ای را که رنگی هستند را به صورت پالسی و منقطع درون سل دستگاه اسپکتروفوتومتر تزریق و از طریق معادله بیر -لامبرت و رابطه غلظت با جذب میتوانند غلظت لحظه ای را بدست آورند . که حتی در این روش هم خطای معینی وجود دارد.
به همین دلیل بهترین راه تعیین مرتبه ها استفاده از روش سرعت اولیه است که از مقدار دقیق غلظت موادی که در ظرف واکنش قرار داده ایم آگاهیم و واکنش هنوز پیشرفت چندانی نکرده است . درغیراین صورت اگر چند ثانیه از واکنش گذشته باشد دیگر نمی توانیم غلظت واقعی را اندازه گیری کنیم چون سریع ترین روش ها برای اندازه گیری غلظت با توجه به در جریان بودن واکنش خطای قابل ملاحظه ای خواهد داشت .
بنا بر تعاریف رایج در فیزیک ، در حال حاضر مواد از لحاظ مغناطیسی به سه رده تقسیم بندی میشوند که عبارتند از :
1- مواد
فرومغناطیس :
مثل آهن که دارای دوقطبیهای مغناطیسی
مولکولی دائمی هستند و در میدانهای آهنربایی در جهت خطوط میدان منظم میشوند و در
شیب میدانِ آهنربایی جذب قسمتِ شدیدترِ میدان میشوند ،
2- مواد
پارامغناطیس :
مثل اکسیژن که دارای دوقطبیهای
مغناطیسی مولکولی دائمی نیستند اما در میدانهای آهنربایی، مولکولها از لحاظ
مغناطیسی دو قطب شمال و جنوبِ مغناطیسی پیدا میکنند یا بهعبارتی در حضور میدانهای
آهنربایی بهنحوی ضعیف جذب قسمتهای شدیدترِ میدان میشوند ،
3- مواد
دیامغناطیس :
مثل بیسموت که نه دارای دوقطبیِ
مغناطیسی دائمی هستند و نه در میدان مغناطیسی مولکولهیا آنها دوقطبیِ مغناطیسی میشوند،
و از قسمتهای شدیدِ میدانِ مغناطیسی رانده میشوند .
توانایی نظریه MO (اوربیتال مولکولی) در مقایسه با نظریه هایی که مبنی اوربیتال های مستقر می باشند را در یک مولکول O2 می توان مشاهده کرد. برای سال ها به نظر می رسید که این امکان وجود نداشت که نظریه یک پیوندی را ارائه داد که با قدرت پیوند و رفتار مغناطیسی O2 مطابقت داشته باشد. از یک طرف داده ها حاکی از این است که مولکول پارامغناطیس است و پیوند دوگانه دارد. از طرف دیگر می توان دو ساختار لوییس برای O2 نوشت که هیچ یک ویژگی های این مولکول را ندارد. یکی پیوند دوگانه با تمام الکترون های جفت شده دارد و دیگری یک پیوند یگانه با دو الکترون جفت نشده دارد.
نظریه MO این تناقض را به خوبی حل می کند. همانطور که در شکل نشان داده شده است مرتبه پیوند برابر با دو می باشد: 8 الکترون اوربیتال های مولکولی پیوندی و 4 تا اوربیتال های مولکولی ضد پیوندی را اشغال می کنند.

براساس نمودارتراز انرژی اوربیتال مولکولی اکسیژن ،آرایش الکترونی مولکول را می توان بصورت زیر نوشت:
یعنی مولکول دارای دوالکترون منفرد (براساس قایده هوند )است و خاصیت پارامغناطیسی دارد.مرتبه پیوند برابر ۲(یک پیوند سیگما ویک پیوند π) است.طول پیوند برابر ۱/۲۰۷آنگستروم وانرژی پیوند برابر ۱۱۸کیلوکالری بر مول است.
خاصیت پارامغناطیسی O2 مایع
در محلول های شیمی 3 انحلال تمام گازها را گرماده بگیم فقط گازهای نجیب رو گرماگیر ؟ یا استثنا هم هست ؟
اثر دما بر حلالیت گازها بیشتر قابل پیش بینی است. برای انحلال یک جامد در مایع مولکول های حل شونده باید از هم جدا شوند. لذا باید انرژی اضاصه گردد. یعنی حل شوندهH∆ بزرگ تر از صفر است. به عکس ذرات در گاز قبلا از هم جدا شده اند لذا حل شوندهH∆ تقریبا برابر صفر می باشد. چون مرحله آبپوشی گرمازاست جمع این دو عبارت باید منفی باشد. بنابراین برای تمام گاز ها در آب محلولH∆ کوچکتر از صفر می باشد. این معادله به این مفهوم استکه حلالیت گاز در آب با دما کاهش می یابد. نیرو های بین مولکولی در گاز ها ضعیف اند لذا نیرو های بین مولکولی بین گاز و آب نسبتا ضعیف اند. با افزایش دما متسط انرژی جنبشی ذرات در محلول زیاد می شود در نتیجه ذرات گاز به آسانی بر این نیرو های ضعیف غلبه و مجددا وارد فاز گاز می شوند.
شیمی عمومی سیلبربرگبرای دانلود فیلم اینجا کلیک کنید.