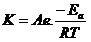برای دانلود فیلم آزمایش اینجا کلیک کنید.
-
موضوعات بحث شده در تلگرام و جمع بندی آن ها
(۱۷۰) -
پاورپوینت های شیمی دوم دبیرستان
(۵) -
پاورپوینت های شیمی سوم دبیرستان
(۶) -
کتب درسی
(۶) -
پاورپوینت شیمی چهارم دبیرستان
(۱) -
سوالات کتب درسی
(۴) -
آزمایش های جذاب شیمی
(۳) -
انیمیشن های فصل به فصل شیمی دوم دبیرستان
(۱۶) -
انیمیشن و فیلم های شیمی سوم دبیرستان
(۴) -
مجموعه تست های شیمی سوم دبیرستان
(۲) -
نمونه سوالات تستی و تشریحی شیمی دوم دبیرستان
(۷) -
نمونه سوالات تستی و تشریحی شیمی سوم دبیرستان
(۷) -
پاسخ فکرکنید ها و خورابیازمایید های کتاب های درسی
(۶) -
سوالات تستی و تشریحی شیمی چهارم دبیرستان
(۹) -
جزوه اموزشی کتب درسی
(۱۱) -
سوالات بررسی شده در انجمن
(۲) -
نمونه سوالات همکاران از کتب شیمی 2و3و4
(۵) -
نمونه سوالات شیمی دهم
(۱۱) -
پاسخ سوالات شیمی دهم و ازمایشگاه علوم
(۷)
- آبان ۱۳۹۷ (۱)
- ارديبهشت ۱۳۹۷ (۲)
- فروردين ۱۳۹۷ (۲)
- بهمن ۱۳۹۶ (۳)
- آذر ۱۳۹۶ (۱)
- آبان ۱۳۹۶ (۳)
- مهر ۱۳۹۶ (۱)
- شهریور ۱۳۹۶ (۱)
- ارديبهشت ۱۳۹۶ (۱)
- بهمن ۱۳۹۵ (۱)
- دی ۱۳۹۵ (۱)
- آذر ۱۳۹۵ (۶)
- آبان ۱۳۹۵ (۱)
- مهر ۱۳۹۵ (۲)
- شهریور ۱۳۹۵ (۳)
- خرداد ۱۳۹۵ (۱)
- ارديبهشت ۱۳۹۵ (۳)
- دی ۱۳۹۴ (۳)
- آذر ۱۳۹۴ (۱)
- آبان ۱۳۹۴ (۸)
- مهر ۱۳۹۴ (۴۱)
- شهریور ۱۳۹۴ (۸۵)
- مرداد ۱۳۹۴ (۱۰۱)
- تیر ۱۳۹۴ (۱۰)
- ۹۷/۰۸/۱۰پاسخ سوالات کتاب شیمی دوازدهم
- ۹۷/۰۲/۲۱پاسخ کل پرسش های کتاب شیمی یازدهم
- ۹۷/۰۱/۱۶نمونه سوالات فصل دوم شیمی دهم
- ۹۷/۰۱/۱۶نمونه سوالات فصل دوم شیمی یازدهم
- ۹۶/۰۹/۰۱پاسخ پرسش های فصل اول شیمی یازدهم
- ۹۵/۰۹/۰۸سوالات تستی فصل اول شیمی دهم
- ۹۴/۰۶/۱۸مقایسه قدرت اسیدی اسیدها
- ۹۴/۰۵/۲۳انرژی شبکه بلور و عوامل موثر بر آن
برای دانلود فیلم آزمایشی اینجا کلیک کنید.
برای دانلود فیلم آزمایش اینجا کلیک کنید.
در باران طلایی دو بحث در مورد بلور سازی را نشان میدهد و فوق اشباح نسبی وتاثیر آن در فرایند هسته زایی و دومی رشد بلور ابتدا در محلول پتاسیم یدید سرب نیترات وارد می کند چون محلول غلیظ است فوق اشباح نسبی بالاست وهسته زایی غالب شده ورسوب ریز دانه است سپس با حرارت رسوب را هضم می کند و اجازه می دهد آرام سرد شود در این حالت فوق اشباح نسبی کم است ورشد بلور غالب است وشکل منظم بلور باعث انکسار نور می شود.
در تغییرات چگالی دوعامل یکی جرم اتمی و دیگری حجم شبکه بلوری فلزات اثر دارد. در مواردی که تغییرات یک خاصیت در گروه روند منظمی ندارد, نشان دهنده ی این است که عوامل مختلف در آن خاصیت اثر می گذارد. در بعضی اتمها یک عامل و در سایر اتم ها عامل دیگری غالب است. تمام فلزات قلیایی در ساختار بلوری مکعبی مرکز پر متبلور می شوند. دانسیته کمتر پتاسیم نسبت به سدیم به این علت است که افزایش حجم مولی پتاسیم بیشتر از افزایش جرم مولی است, زیرا هشت عنصر بین این دو عنصر قرار دارند. ولی بین روبیدیم و پتاسیم هجده عنصر وجود دارد, لذا افزایش در جرم مولی بر افزایش در حجم مولی غلبه می کمد. در نتیجه دانسیته روبیدیم بیشتر از پتاسیم است.
منبع: کتاب شیمی عمومی دکتر پارسافر
رابطه آرنیوس تاثیر دما ورابطه نمایی آن بر سرعت همه واکنش هایی شیمیایی است ولی برای واکنش های گرماگیر ملموس تر است
مقدار R در این رابطه برای یک گونه ی گازی ثابت عمومی گازها برای یک مول گاز است.
می توان از رابطه آرنیوس برای مایع یا جامد هم استفاده نمود اساس آن را با فرضیاتی برای تمام واکنشها به کار مببربم
ثابت گازها ۸٫۳۱۴ ژول بر مول کلوین و ۰٫۰۸۲ لیتر اتمسفر بر مول کلوین است و در صورتی که برحسب کالری باشد 1.98 می توان در نظر گرفت. اگر این رابطه برای این فازها پاسخ گو نباشد در آنصورت پس نباید بتوان ثابت سرعت را برای مواد جامد یا مایع بدست آورد بحث جامدات که جدا است ولی مایعات فرکانس برخوردشان کمتر است که در معادله آرنیوس تحت عنوان فاکتور احتمال امده است
رابطه بین دما و ثابت سرعت(رابطه آرنیوس)
درA فاکتور احتمال شکل مولکول و عوامل دخیل در برخورد وجاذبه های مولکولی و.... دخالت داده می شود. معادله آرنیوس بر اساس نظریه برخورد و برای فاز گاز است .نتیجه آن برای محلول ها هم همسو با گازها ست نه مشابه.
رابطه ارنیوس برای محاسبه انرزی فعالسازی است ولی ثابت سرعت را هم میتوان از روی انرژی فعالسازی معلوم محاسبه کرد.
ثابت های سرعت را در دو دمای متفاوت محاسبه کرده ولگاریتم2 K به K1 را برحس دما رسم می کنیم.
با توجه به اینکه تغییر غلظت و فشار را با تغییر Q شرح می دهیم تغییر دما را نمی توان با تغییر Q شرح داد، زیرا دما ثابت تعادل را تغییر می دهد و امکان مقایسه Q را ب K قبلی وجود ندارد باید باK جدید مقایسه شود.
اصل لوشاتلیه از چند جنبه درتعادل قابل کاربرد است 1 غلظت 2 فشار 3 دما . بسته به نوع واکنش وحالت فیزیکی اجزای تعادل تفسیر آن متفاوت است، مثلا در تعادلات گازی که تعداد مول گازی دو طرف برابر است ودر محلول ها فشار تاثیر ندارد، در محلول ها وگاز ها غلظت تاثیر دارد ودر اغلب واکنشها دما تاثیر دارد به جز واکنش استری شدن وانحلال نمک طعام درآب که تاثیر دما اندک است. هر تغییری در غلظت چه ناشی از افزایش غلظت یکی از مواد یا همه مواد ویا ناشی از تغییر فشار یاحجم ظرف تعادلی را می دهد که ثابت تعادل تغییر نمی کند ولی غلظت های تعادلی تغییر می کند. امادر مورد تغییر دما هم غلظت ها تغییر می کند هم ثابت تعادل
CaCO3--------- CaO+CO2 k= CO2
K ثابت این تعادل با فشار تغییر نمی کند بلکه با دما تغییر می کند. بافشار فقط تعادل جابجا می شود. اگر دما ثابت باشد فشار را کم یا زیاد کنید تعادل به راست یا به چپ جابجا می شود. ولی تغییر فشار گاز بدون دستکاری حجم ظرف یا فشار خارجی فقط ناشی از تغییر دما است. اگر حجم تغییر کند فشار تغییر نمی کند و اگر تغییر کند طبق رابطه بالا K تغییر می کند فشار گاز کربن دی اکسید در این معادله مساوی غلظت گاز کربن دی اکسید است ونمی تواند K ثابت تعادل راتغییر دهد. ثابت تعادل فقط با دما تغییر می کند.
افزایش فشار CO2 انحلال پذیری آن را طبق قانون هنری زیاد می کند، غلظت گاز با فشار گاز متناسب است.
در واکنش بالا اگر مقداری آب اضافه کنیم تعادل به کدام سمت جابجا می شود؟
آب در ثابت این تعادل نقشی ندارد و جابجایی ایجاد نمی کند، چون به شکل خالص است و اگر به شکل بخار بود اثر داشت
اثر آب بخاطر تغییر غلظت به شرطی که افزودن آب دما را تغییر ندهد چندان روی رنگ تعادل اثر ندارد ولی اگر دما تغییر کند اثر دارد. مقدار زیاد آب تغییر غلظت قابل ملاحظه است. اگر اب هم دما اضافه کنیم غلظت محلول کم می شود پس باید تعادل به چپ جابجا شود تا کاهش غلظت را تعدیل کند. چون جابجایی به چپ یا راست با افزودن آب کم اتفاق میافتد شدت رنگ خیلی تغییر نمی کند اثر دما محسوس تر است
چرا این تعادل با افزایش دما به سمت به چپ جابجا می شود؟ چون Q از Kبیشتر می شود باید به سمت چپ برود.
اثر دما در جابجایی به چه دلیلی است؟
از انجا که در واکنشهای تعادلی رفت وبرگشت بنیادی در نظر گرفته می شوند تغییر دما به خاطر تشکیل کمپلکس با لیگاند ضعیف است البته کمپلکس سمت چپ هشت وجهی وسمت راست 4وجهی است. اگر حجم این سامانه کاهش یابد فشار گاز افزایش می یابد وطبق اصل لوشاتلیه تعادل به سمت چپ جابجا می شود وچون K فقط تابع دما است باید فشار گاز CO2کاهش یافته وبر خلاف اصل لوشاتلیه به فشار اولیه برسد تا مقدار K ثابت بماند.
در یکی از موارد واکنش تولید آمونیاک در دما و فشار ثابت اگر نیتروژن را اضافه کنیم به گونه ای که مول آغازی نیتروژن 0.5 بیشتر شود علی رغم اضافه کردن نیتروژن تعادل بر خلاف اصل لوشاتلیه به سمت چپ جابه جا می شود.
اگر چه غالبا آمینو اسیدها را طوری نشان می دهند که یک گروه امینی و یک گروه کربوکسیل دارند ولی برخی خواص انها با این ساختار توافق ندارد در واقع امینو اسیدها در شکل خالص به صورت زوج یون یا یون های دو قطبی هستند یعنی باید هیدروژن اسیدی کربوکسیلیک را به قسمت امینی منتقل نمایید یعنی در یک قسمت کربوکسیلات منفی و در قسمت دیگه امونیم مثبت خواهیم داشت این ساختار تمامی ویژگی های امینواسیدها را در جدول کتاب پیش توجیه می کند
از ترکیباتی که دارای نیروهای جاذبه از نوع یونی هستند انتظار دماهای ذوب و جوش بالا میرود
انتظار نداریم در محلول های آلی مثل الکل و دی اتیل اتر حل شوند
البته یکی ازدلایل دیگه ای هم که بر این ساختار تاکید می کند این است کهثابت های اسیدی و بازی ان ها خیلی کمتر از کربوکسیلیک اسیدها و امینهاست و خاصیت بازی ان در حدود استات ها و خاصیت اسیدی ان در حدود امونیم است، همچنین محلول های انها گشتاور دو قطبی بالایی دارند و مشابه نمکها می باشد. وقتی این ترکیبات در اب حل می شوند بسته بهpH محلول اشکال مختلفی می توانند داشته باشند و در نقطه ایزو الکتریک شکل کتاب را خواهند داشت.
منبع: کتاب شیمی آلی موریسون و بوید
برای دانلود سوالات و پاسخنامه اینجا کلیک کنید.
برای دانلود سوالات اینجا کلیک کنید.