رادیواکتیو (پرتوزایی ) عبارت است از خاصیت تجزیه خود بخود بعضی از اتمها
که در آن هسته یک عنصر اشعه آلفا، بتا و گاما صادر می کند . این خاصیت صدور اشعه بدون
محرک خارجی است که در آن اتمها یا ایزوتوبهای یک عنصر به اتمهای عنصر یا ایزوتوپ دیگر
تبدیل می شوند که این ایزوتوپها یا اتمها ممکن است طبیعی یا مصنوعی باشند . عناصررادیواکتیو
طبیعی ایزوتوپهای رادیواکتیوی هستند که درهمان زمان تشکیل عناصر دیگر در هنگام پیدایش
کره زمین به وجود آمده اند
آشناترین عنصرهای رادیواکتیو ،اورانیم و توریم هستند .باشکسته شدن پی
در پی هسته های اورانیم ،رادیوم بدست می آید که عنصری رادیو اکتیو و دارای هسته ای
ناپایدار است ،شکستن هسته ی این عنصر هم تا آنجا ادامه می یابد تاعنصری با هسته ی پایدار
به نام سرب ساخته شود که پایدار است.
اما عناصر رادیواکتیو مصنوعی ایزوتوپهایی
هستند که در اثر واکنشهای هسته ای که در مراکز تحقیقاتی و آزمایشگاهی بوسیله شتاب دهنده
های قوی انجام می گیرد کشف گردیده اند
چنانکه یک عنصر با ذره های باردار آلفا یابتا ویاپرتوهای یون ساز بمباران
شوند رادیواکتیوساختگی یا مصنوعی بدست می آید مثالی که می توان برای این پدیده زد
.بدست آوردن کبالت ۶۰از فلز کبالت ۵۹طبیعی است.برای این کار کبالت ۵۹را در راکتورهسته ای در برابر بمباران نوترونی
می گذارند .در اثربمباران کبالت ۵۹بر
اثر واکنش هسته ای
باگرفتن یک نوترون به کبالت ۶۰تبدیل
می شود.درصنعت از این کبالت برای پرتونگاری و گندزدایی مواد غذایی بهره گیری می کنند.
.تشعشعات
هسته ای از هسته اتم های رادیواکتیو صادر می شوند ، بدین صورت که هسته در حین تجزیه
آنها را منتشر می کند ، که میزان نشر آنها به درجه حرارت یا فشار بستگی ندارد . پس
بطور خلاصه پدیده پرتوزایی از اتمهای عناصر با هسته ناپایدار به وجود می آید . اما
دانش مندان چه هسته های پایدار و چه هسته های ناپایدار می دانند؟ دانشمندان برای این
منظور بطور ساده نسبت تعداد نوترون / پروتون را مد نظر قرار داده اند ، بطوریکه برای
هسته های پایدار عناصر سبک این نسبت تعداد برابر عدد یک است و برای عناصر سنگین تر
این نسبت 5/1 است ، در این صورت بزرگترین هسته پایدار Bi209
83
است و هسته های بزرگتر از این همگی رادیواکتیو هستند بطور مثال At98/209
85 .
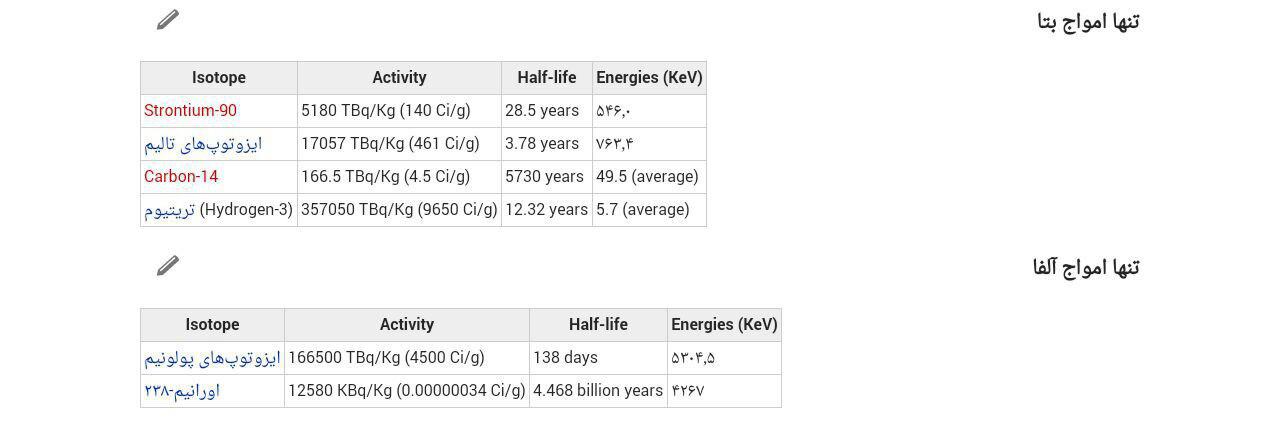
باید بدانیم همه مواد رادیواکتیو ممکن نیست همزمان هر سه اشعه آلفا و
بتا و گاما نشر کنند بطور نمونه اگر چه هسته های طبیعی و مصنوعی هر دو دچار نشر آلفا
می شوند اما این عمل فقط برای هسته هایی که جرم اتمی آنها بیشتر از 209 و عدد اتمی
آنها بیشتر از 82 است معمول است .و نشر بتا برای هسته هایی مشاهده می شود که نسبت نوترون
/ پروتون آنها از نسبتی که برای پایداری لازم است بسیار زیاد تر باشد ، بنابراین منبع
اشعه بتا ، ایزوتوپهای رادیواکتیو مصنوعی است و تعداد کمی از عناصر رادیواکتیو طبیعی
منبع این اشعه هستند و اشعه گاما اغلب همراه با اشعه آلفا و بتا گسیل می شود .از هسته
اتم ناپایدار علاوه بر اشعه آلفا و بتا و گاما ، گسیل پوزیترون ، گیراندازی الکترون
و گسیل نوترون رخ می دهد که این پدیده ها را همه عناصر رادیواکتیو از خود نشان نمی
دهند .
بطور نمونه گسیل یوزیترون 12253 I =
12252 Te +1e و گیراندازی الکترون -1 e
+10647 Ag = 10646pd.