مفهوم الکترون خواهی
الکترون خواهی
الکترون خواهی یاالکترون آفینیته مربوط به فرآیندی است که در آن ، یک اتم گازی شکل با کسب الکترون به یک یون منفی گازی تبدیل می شود ، به انرژی که طی این فرآیند مصرف یا آزاد میشود الکترونخواهی آن عنصر گفته می شود.(با حفظ علامت انرژی)
M (g) + 1e- --> M- (g)
فرآیند الکترونخواهی از نظر کسب الکترون با فرآیند یونش کاملا برعکس همدیگر است .با این تفاوت که انرژی یونش همیشه مثبت است و الکترونخواهی هم می تواند منفی و هم مثبت باشد. انرژی یونش مربوط به فرآیند تولید یک یون مثبت گازیاز اتم خنثی گازی بسبب از دست دادن الکترون است.
M(g) + فوتون --> M+(g) + 1e-
علامت قراردادی الکترون خواهی
در فرآیند الکترون خواهی معمولا (ولی نه همیشه) انرژی آزاد میشود. اولین الکترون خواهی بیشتر عناصر ، علامت منفی دارد .
الکترونخواهی عناصرگروه ۲ وگروه گازهای نجیب و یکی دو موردخاص مثبت است در گروه دوم آرایش ns2 پایداراست و اتم نمی خواهد الکترون بگیرد به همین دلیل اغلب الکترونخواهی این گروه مثبت است .
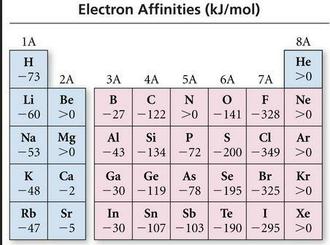
درگروه یک الکترونخواهی منفی است وگروه ۱۳وگروههای نافلزی ( بجز گازهای نجیب) الکترونخواهی منفی است.
چه عواملی در علامت و مقدار انرژی الکترونخواهی عناصر موثر است؟
همانطوری که میدانید برای گرفتن یک الکترون لازم است یک اتم شرایط زیر را داشته باشد .
الف- الکترونگاتیوی و بار موثر هسته آن زیاد باشد.
ب- آرایش الکترونی آن با گرفتن یک الکترون ناپایدارتر نشود.
ج- شعاع اتم به اندازه کافی بزرگ باشد تا الکترون گرفته شده را در لایه ظرفیت خود جای دهد و دافعه الکترونهای موجود روی الکترون تازه وارد کم باشد.
در مورد الکترونگاتیوی و بار موثر هسته گروه هالوژنها تقریبا الکترونخواهی بالایی دارند.
در مورد آرایش الکترونی گروه 2 و 15 و 18 چون با گرفتن الکترون ناپایدار می شوند پس تمایلی به گرفتن الکترون نداشته الکترونخواهی آنها یا مثبت است یا اندازه آن کوچک است.
در مورد اندازه اتم الکترونخواهی کلر(349-) از فلوئور(328-) و گوگرد (200-)از اکسیژن (141-) بیشتر است چون شعاع عناصردوره سوم از دوره دوم بزگتر می باشد.
علت آزاد شدن انرژی یا جذب انرژی توسط اتم در الکترون خواهی چیست؟
الکترونی که به اتم خنثی نزدیک میشود، از سوی هسته مثبت اتم جذب میشود. اما از سوی الکترونهای منفی آن دفع میگردد. اگر جاذبه بیش از دافعه باشد، وقتی یون منفی بوجود میآید، انرژی آزاد میشود. برعکس اگر دافعه بیش از جاذبه باشد، برای تشکیل یون منفی باید به سیستم انرژی داده شود.
تغییرات الکترون خواهی در یک تناوب از جدول تناوبی
در یک دوره از چپ به راست انتظار اینست که با افزایش الکترونگاتیوی وبار موثر هسته الکترونخواهی بیشتر شود ولی روند آرایش الکترونی گروه 2 و15 و18 اثر معکوس دارد .
در یک گروه از بالا به پایین اگر چه الکترونگاتیوی کم میشود وباید الکترونخواهی کاهش یابد ولی چون اندازه اتم بزرگ میشود این روند کاهشی شیب آرامی دارد.
دومین الکترون خواهی
فرآیندی است که در آن یک الکترون به یک یون منفی افزوده میشود. برای نمونه در مورد اکسیژن برابر است با Ea2=+845 Kj/mol ازآنجایی که یک یون منفی و یک الکترون یکدیگر را دفع میکنند، در فرآیند افزودن یک الکترون به یک یون منفی نهتنها انرژی آزاد نمیشود بلکه انجام فرآیند گرماگیر است و دومین الکترون خواهی تمامی عناصر ، مقداری مثبت دارد.
انرژی تبادل شده در فرآیند تولید یون
انرژی تبادل شده در فرآیند تولید یونی که دو یا چند بار منفی دارد، حاصل جمع جبری تمام الکترون خواهی مربوط است. این حاصل جمع برای تمام یونهای دارای چند بار منفی همیشه مثبت و فرآیند انرژی گیر است.