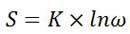مفهوم آنتروپی و عواملی که در انتروپی موثرند
مفهوم آنتروپی در سال 1865 توسط
رودولف کلازیوس دانشمند آلمانی برای توجیه جهت انجام فرایندهای فیزیکی و شیمیایی
ارائه شد.کلازیوس گرمای آزاد شده یا جذب شده توسط سامانه، تقسیم بر دمای سامانه
(بر حسب کلوین) را آنتروپی نامید. اما این ایده که آنتروپی به عنوان معیاری برای
میزان بی نظمی در نظر گرفته شود، نخستین بار توسط لودویک بولتزمن مطرح شد. برخلاف آنتالپی و انرژی درونی که نمی توان آنها را به طور مطلق
تعیین نمود، در مورد آنتروپی می توان مقدار مطلق آن را برای هر ماده تعیین کرد.
اما چگونه می توان آنتروپی مطلق مواد را اندازه گیری کرد؟
بولتزمن توانست با یک مقدار ثابت (K) بین آنتروپی(S) و تعداد آرایش های ممکن برای ذرات موجود در یک سیستم در دمای معین (ω) رابطه ای ایجاد کند؛
آنتروپی مطلق یک ماده خالص مانند یک بلور کامل و بی نقص در صفر کلوین (صفر مطلق) برابر با صفر است. علت آن است که در یک بلور کامل و بی نقص ذرات تنها در یک حالت می توانند قرار گیرند تا چنین بلوری را به وجود آورند. یعنی ω=1. همانطور که از قوانین لگاریتم می دانید Ln1=0؛ در نتیجه آنتروپی (S) نیز در این دما برابر صفر می شود. هرچه دما افزایش یابد، ماده گرما را جذب کرده و رو به بی نظمی می رود و ذرات آن آرایش های مختلفی به خود می گیرند. با افزایش دما تا حد مورد نظر و در نظر گرفتن صفر برای آنتروپی اولیه می توان آنتروپی ماده را از طریق روابط زیر بدست آورد:
از جمله مهم ترین عواملی که در آنتروپی موثر است می توان به موارد زیر اشاره کرد:
1- دما دما عامل بسیار مهمی در انتروپیست با افزایش دما انتروپی افزایش میابد با افزایش دما تعداد حالت های میکروسکوپی بیشتری امکان پذیر است.
2- حالت فیزیکی افزایش انتروپی از مایع به گاز بسیار بزرگتر از جامد به مایع است3- حل شدن جامد در مایع انتروپی جامد یا مایع مولکولی حل شده بزرگتر از انتروپی ماده حل شونده خالص است ولی در مورد حل شونده های یونی ماهیت حل شونده و حلال در تغییر کلی موثر است برخی از یونها که چگالی بالایی دارند باعث سازمان یافته شدن مولکولهای اب می شوند و حرکت انها کمتر می شود و انتروپی گاهی کاهش می یابد ولی افزایش انتروپی برای محلول های مولکولی به طور معمول کوچکتر از محلولهای یونی است الکل های کوچک مثل متانول و اتانول به دلیل پیوندهای هیدروژنی افزایش انتروپی کوچکی دارند.البته انحلال گازها نیز با کاهش انتروپی همراه است
4- برای موادی که در یک فاز هستند اندازه اتم و پیچیدگی مولکول نیز باعث افزایش انتروپی می شود مثلا فلزات قلیایی با افزایش جرم سطوح انرژی بهم نزدیکتر می شود لذا انتروپی مولی افزایش میابد.یا مثلا هیدروژن هالیدها در فاز گازی با افزایش جرم انتالپی افزایش میابد برای الوتروپهای متفاوت نیز آزادی برای آلوتروپی که ازادی حرکت بیشتری دارد بیشتر است مثلا گرافیت انتروپی بیشتری نسبت به الماس دارد با افزایش تعداد اتمها در یک ترکیب در فاز یکسان نیز انتروپی افزایش میابد مثلا دی نیتروژن تتراکسید انتروپی بیشتر از نیتروژن دی اکسید و بیشتر از نیتروژن اکسید است تعداد ارتعاشات با افزایش کربن در الکانها اگر در یک فاز باشند انتروپی افزایش میابد